 |
 |
- Search
| Epilia: Epilepsy Commu > Volume 4(2); 2022 > Article |
|
Abstract
Posterior reversible encephalopathy syndrome (PRES) is a neurological disorder characterized by its reversibility both radiologically and clinically, and it typically has a favorable prognosis. Its etiopathogenesis is not clear, although it is known that it involves endothelial dysfunction of the posterior cerebral vasculature, leading to failed cerebral autoregulation. We report a patient with PRES that may have been caused by an immune-mediated response to decitabine.
Ļ░ĆņŚŁņĀü Ēøäļćīļ│æņ”Ø ņ”ØĒøäĻĄ░(posterior reversible encephalopathy syndrome, PRES)ņØĆ 1996ļģä Hinchey ļō▒1ņØ┤ 15ļ¬ģņØś ĒÖśņ×Éļź╝ ļČäņäØĒĢśņŚ¼ ņ▓śņØīņ£╝ļĪ£ ņĀ£ņĢłĒĢ£ ņÜ®ņ¢┤ļĪ£, Ļ│ĀĒśłņĢĢĻ│╝ ņ×ÉĻ░äņ”Ø, ņŗĀņןņ¦łĒÖś ĒÖśņ×É ļśÉļŖö cyclosporine, tacrolimus, methotrexate ļō▒Ļ│╝ Ļ░ÖņØĆ ļ®┤ņŚŁņ¢ĄņĀ£ņĀ£ ļ░Å ņäĖĒżļÅģņä▒ ņĀ£ņĀ£ ņ╣śļŻīļź╝ ļ░øņØĆ ĒÖśņ×ÉņŚÉņä£ ļéśĒāĆļéĀ ņłś ņ׳ļŗż. PRES ĒÖśņ×ÉņŚÉņä£ļŖö ļæÉĒåĄ, ĻĄ¼ņŚŁ, ĻĄ¼ĒåĀļ┐É ņĢäļŗłļØ╝ ņŗ£ļĀź ņĀĆĒĢśņÖĆ ļ░£ņ×æĻ│╝ Ļ░ÖņØĆ ĻĄŁņåīņĀü ņŗĀĻ▓ĮĒĢÖņĀü ņØ┤ņāüĻ│╝ ĒĢ©Ļ╗ś ĒŖ╣ņ¦ĢņĀüņØĖ ļćīņśüņāüĻ▓Ćņé¼ ņØ┤ņāüņØ┤ ļÅÖļ░śļÉśļŖöļŹ░, ņŻ╝ļĪ£ ņ¢æņ¬Į ļīĆļćī Ēøäļ░®ņŚÉ ĻĄŁĒĢ£ļÉśļŖö ĒśłĻ┤Ćņä▒ ļćīļČĆņóģņØ┤ļŗż.2 ļīĆļćīĒö╝ņ¦łņØĆ ļ░▒ņ¦łļČĆļ│┤ļŗż ļŹöņÜ▒ ņ╣śļ░ĆĒĢśĻ│Ā ņĪ░ņ¦üĒÖöļÉśņ¢┤ ņ׳ņ¢┤ ļČĆņóģņŚÉ ļīĆĒĢ┤ ņĀĆĒĢŁņä▒ņØ┤ ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ PRES ļ░£ņāØ ņ┤łĻĖ░ņŚÉ ļČĆņóģņØ┤ Ēö╝ņ¦łņŚÉņä£ ļ©╝ņĀĆ ņŗ£ņ×æļÉśļŹöļØ╝ļÅä ļ¦ÄņØĆ ņłśļČäņØ┤ ņīōņØ┤ņ¦Ć ļ¬╗ ĒĢśĻ│Ā, ļ│æļ│ĆņØ┤ ņ¦äĒ¢ēļÉśļ®┤ņä£ Ēö╝ņ¦łĒĢś ļ░▒ņ¦ł ļČĆņ£äļĪ£ ļČĆņóģņØ┤ ņØ┤ļÅÖĒĢśĻ▓ī ļÉśļŖöļŹ░, ņ┤łĻĖ░ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŗ£Ļ░äņØ┤ Ļ▓ĮĻ│╝ĒĢ£ ņżæļō▒ļÅä ņØ┤ņāüņØś ĒÖśņ×ÉļōżņØ┤ ņŻ╝ļĪ£ ĒżĒĢ©ļÉśņ¢┤ ņ׳ņ¢┤ PRES ĒÖśņ×ÉņŚÉņä£ņØś ļČĆņóģņØĆ Ēö╝ņ¦łĒĢś ļ░▒ņ¦ł ļČĆņ£äņŚÉņä£ļ¦ī Ļ┤Ćņ░░ļÉ£ļŗżĻ│Ā ņśżņØĖĒĢśņśĆļŗż.3 ĒĢśņ¦Ćļ¦ī, ņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāü(magnetic resonance imaging, MRI) ĻĖ░ņłĀņØś ļ░£ņĀäņ£╝ļĪ£ fluid-attenuated inversion recovery (FLAIR) ņśüņāüĻĖ░ļ▓ĢņØ┤ ņČ£ĒśäĒĢśļ®┤ņä£ PRES ĒÖśņ×ÉņŚÉņä£ Ēö╝ņ¦łĒĢś ļ░▒ņ¦łļ┐É ņĢäļŗłļØ╝ Ēö╝ņ¦łņŚÉņä£ļÅä ļćī ļČĆņóģņØ┤ ĒÖĢņØĖļÉśņŚłņ£╝ļ®░, ĒśłĻ┤ĆņØś ĻĄÉĻ░ÉņŗĀĻ▓ĮņØ┤ ņāüļīĆņĀüņ£╝ļĪ£ ņĀüĻ▓ī ļČäĒżļÉśņ¢┤ ņ×ÉļÅÖņĪ░ņĀłļŖźņØ┤ ņĘ©ņĢĮĒĢśņŚ¼ MRI ņØ┤ņāü ņåīĻ▓¼ņØ┤ ņŻ╝ļĪ£ ļéśĒāĆļéśļŖö ļæÉņĀĢ ĒøäļæÉņŚĮ ņÖĖņŚÉļÅä ņĀäļæÉņŚĮ, ņĖĪļæÉņŚĮ, ņåīļćī, ĻĖ░ņĀĆĒĢĄ, ļśÉļŖö ļćīĻ░äņŚÉņä£ļÅä ļ│æļ│ĆņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż.2,3 ņØ┤ļ¤¼ĒĢ£ ļ│æļ│ĆņØĆ ņĀäĒśĢņĀüņ£╝ļĪ£ļŖö Ļ░ĆņŚŁņĀüņØ┤ņ¦Ćļ¦ī, ļō£ļ¼╝Ļ▓ī ņäĖĒżļÅģņä▒ ļČĆņóģņØ┤ļéś ļćīņČ£ĒśłņØ┤ ļÅÖļ░śļÉśņ¢┤ ļéśņü£ ņśłĒøäļź╝ ļ│┤ņØ╝ ņłś ņ׳ļŗż.2
PRESņØś ļ░£ļ│æ ĻĖ░ņĀäņØĆ ņĢäņ¦üļÅä ļ¬ģĒÖĢĒĢśĻ▓ī ĻĘ£ļ¬ģļÉśņ¦Ć ņĢŖņĢśņ¦Ćļ¦ī, ņśżļל ņĀäļČĆĒä░ Ļ│ĀĒśłņĢĢņŚÉ ņØśĒĢ£ ĒśłņĢĪļćīņןļ▓Į ņåÉņāüņ£╝ļĪ£ ņØĖĒĢ┤ ĒśłĻ┤Ćņä▒ ļČĆņóģņØ┤ ļ░£ņāØĒĢĀ Ļ▓āņØ┤ļØ╝Ļ│Ā ņāØĻ░üĒĢśņśĆļŗż. ĒĢśņ¦Ćļ¦ī 20%ņŚÉņä£ 30%ņØś ĒÖśņ×ÉļōżņØĆ ĒśłņĢĢņØ┤ Ļ▒░ņØś ņĀĢņāüņØĖ Ļ▓ĮņÜ░Ļ░Ć ņ׳ņ¢┤2 ļ¬©ļōĀ PRESņØś ļ│æĒā£ņāØļ”¼ļź╝ ņĀĢĒÖĢĒĢśĻ▓ī ņäżļ¬ģĒĢśĻĖ░ ņ¢┤ļĀĄļŗż. ņĄ£ĻĘ╝ņŚÉļŖö ĒśłĻ┤Ćļé┤Ēö╝ņäĖĒż ņåÉņāüņØ┤ PRESļź╝ ņäżļ¬ģĒĢśļŖö Ļ░ĆņäżļĪ£ ņĀ£ĻĖ░ļÉśņŚłļŖöļŹ░,2 ņøÉņØĖņŚÉ ļö░ļØ╝ ĒĢŁņĢöņĀ£ņÖĆ Ļ░ÖņØĆ ļÅģņä▒ ļ¼╝ņ¦łņØ┤ļéś ņ╝Ćļ¬©ņ╣┤ņØĖņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢśļŖö ņäĖĒżļÅģņä▒ Ļ░Ćņäż(cytotoxic theory)Ļ│╝, TņäĖĒżļź╝ Ļ▓Įņ£ĀĒĢ£ ļ®┤ņŚŁņ▓┤Ļ│äņØś ĒÖ£ņä▒ņØä Ļ░ĢņĪ░ĒĢ£ ļ®┤ņŚŁņøÉņä▒ Ļ░Ćņäż(immunogenic theory)ļĪ£ ļéśļłī ņłś ņ׳ļŗż.4 ņØ┤ļź╝ ĒåĄĒĢ┤ ļŗżņ¢æĒĢ£ ĒĢŁņĢöņĀ£ļōżņØś PRES ļ░£ņāØ ĻĖ░ņĀäņØä ņäżļ¬ģĒĢĀ ņłś ņ׳ļŖöļŹ░, ņĀĆņ×ÉļōżņØĆ Ļ│©ņłśĒśĢņä▒ņØ┤ņāüņ”ØĒøäĻĄ░(myelodysplastic syndrome, MDS)ņŚÉņä£ ņé¼ņÜ®ļÉśļŖö DNA ļ®öĒŗĖņĀäņØ┤ĒÜ©ņåīņĀĆĒĢ┤ņĀ£(DNA methyl-transferase inhibitors)ņØĖ ļŹ░ņŗ£ĒāĆļ╣ł(decitabine; 5-aza-2ŌĆÖdeoxycytidine) ņ╣śļŻī Ēøä PRESĻ░Ć ļ░£ņāØĒĢ£ ņ”ØļĪĆļź╝ ņ▓śņØīņ£╝ļĪ£ Ļ▓ĮĒŚśĒĢśņśĆĻĖ░ņŚÉ ņØ┤ļź╝ ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
76ņäĖ ņŚ¼ņ×É ĒÖśņ×ÉĻ░Ć ņŻ╝ļĪ£ ņóīņĖĪ ĒīöņŚÉ ļéśĒāĆļéśļŖö ņĀäņŗĀ Ļ░äļīĆņä▒ Ļ▓ĮļĀ©ņØä ņŻ╝ņåīļĪ£ ĒāĆņøÉņŚÉņä£ ļ│ĖņøÉ ņØæĻĖēņŗżļĪ£ ņĀäņøÉļÉśņŚłļŗż. ĒÖśņ×ÉļŖö ļŗ╣ļć©ņÖĆ Ļ│ĀĒśłņĢĢ ļ│æļĀźņØ┤ ņ׳ņŚłņ£╝ļéś, ļćīņĪĖņżæ, ņ╣śļ¦ż ļō▒ ņŗĀĻ▓ĮĻ│╝ Ļ┤ĆļĀ© Ļ│╝Ļ▒░ ļ│æļĀźņØĆ ņŚåņŚłļŗż. ļŗżļ¦ī, ļ│ĖņøÉ ļé┤ņøÉ 2ļģä ņĀäņŚÉ ĒśłņĢĪĻ▓Ćņé¼ņŚÉņä£ ņÜ░ņŚ░Ē׳ ļ▓öĒśłĻĄ¼Ļ░Éņåīņ”Ø ņåīĻ▓¼ņØ┤ ļ│┤ņŚ¼ ņŗ£Ē¢ēĒĢ£ Ļ│©ņłś ņāØĻ▓ĆņŚÉņä£ ļŗżĻ│äņŚ┤ ņØ┤ĒśĢņä▒ņØä ļÅÖļ░śĒĢ£ MDSļĪ£ ņ¦äļŗ©ļ░øņØĆ ļÆż 5Ļ░£ņøöĻ░ä cyclosporineņØä Ēł¼ņŚ¼ļ░øņĢśņ¦Ćļ¦ī, ĒÜ©Ļ│╝Ļ░Ć ņŚåņ¢┤ ļé┤ņøÉ 5ņŻ╝ ņĀäņŚÉ ņżæļŗ©ĒĢ£ ĻĖ░ņÖĢļĀźņØ┤ ņ׳ņŚłļŗż. ņØ┤Ēøä ļé┤ņøÉ 3ņŻ╝ ņĀäņŚÉ ļŹ░ņŗ£ĒāĆļ╣łņØä 1ĒÜī Ēł¼ņŚ¼ļ░øņĢśĻ│Ā, ļŗżņØī ļéĀ ņĀäņŗĀ ņ£äņĢĮĻ░ÉņØä ĒśĖņåīĒĢśņŚ¼ ņłśņĢĪ ņ╣śļŻī Ēøä Ēć┤ņøÉĒĢśņśĆņ£╝ļ®░, ļŗ╣ņŗ£ ņŗ£Ē¢ēĒĢ£ ļćī MRIņŚÉņä£ ņØ┤ņāü ņåīĻ▓¼ņØĆ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. ņØ┤Ēøä ļŹö ņØ┤ņāüņØś ļŹ░ņŗ£ĒāĆļ╣ł Ēł¼ņŚ¼ļŖö ņŚåņŚłļŗż.
ļ│ĖņøÉ ļé┤ņøÉ ļŗ╣ņŗ£ ĒÖ£ļĀźņ¦ĢĒøäļŖö ĒśłņĢĢ 110/70 mmHg, ļ¦źļ░Ģ ņłś 122ĒÜī/ļČä, ĒśĖĒØĪ ņłś 24ĒÜī/ļČä, ņ▓┤ņś© 36.8┬░CņśĆĻ│Ā, ņØ┤ņĀä ļ│æņøÉņŚÉņä£ Ēł¼ņŚ¼ĒĢ£ lorazepamņ£╝ļĪ£ Ēś╝ļÅł ņāüĒā£ņśĆļŗż. ņØ╝ļ░ś ĒśłņĢĪĻ▓Ćņé¼ ļ░Å ņāØĒÖöĒĢÖĻ▓Ćņé¼ ņżæ ļ░▒ĒśłĻĄ¼ ņłśņ╣śļŖö 3,400/╬╝L, ņĀüĒśłĻĄ¼ļŖö 10.7 g/dL ļ░Å ĒśłņåīĒīÉņØĆ 18,000/╬╝LļĪ£ ļ▓öĒśłĻĄ¼Ļ░Éņåīņ”Ø ņØ┤ņÖĖņŚÉ Ļ░äĻĖ░ļŖźĻ▓Ćņé¼ļéś ņŗĀņןĻĖ░ļŖźĻ▓Ćņé¼ņāü ņØ┤ņāü ņåīĻ▓¼ņØĆ ņŚåņŚłļŗż. ļ░£ņ×æ ņøÉņØĖ ĒÅēĻ░Ćļź╝ ņ£äĒĢ┤ ņŗ£Ē¢ēĒĢ£ ļćīņ▓ÖņłśņĢĪ Ļ▓Ćņé¼ņŚÉņä£ļÅä ļ¬©ļōĀ ņłśņ╣śĻ░Ć ņĀĢņāü ļ▓öņ£äņŚÉ ņåŹĒĢśņśĆļŗż.
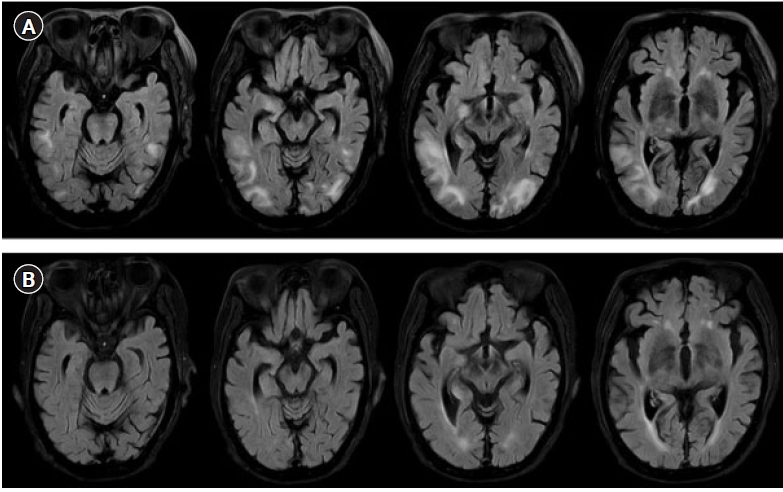
ļ│ĖņøÉ ņĀäņøÉ ļÆż ļ░£ņ×æ ņåīĻ▓¼ņŚÉ ļīĆĒĢ┤ ĒÖśņ×ÉņŚÉĻ▓ī ļćīĒīīĻ▓Ćņé¼ ņŗ£Ē¢ēĻ│╝ ĒĢ©Ļ╗ś lorazepam 2 mgņØä ņĀĢļ¦ź ņŻ╝ņé¼ĒĢśņśĆņ¦Ćļ¦ī ņ”Øņāü ĒśĖņĀäņØĆ ņŚåņŚłĻ│Ā, ņÜ░ņĖĪņŚÉņä£ 2ŌĆō3 HzņØś ņŻ╝ĻĖ░ĒÄĖņĖĪ ļćīņĀäņ”Øļ¬©ņ¢æ ļ░®ņĀäņØ┤ ņ¦ĆņåŹņĀüņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśņ¢┤(Fig. 1A) levetiracetam 1 gņØä ļČĆĒĢś Ēł¼ņŚ¼ĒĢśņśĆļŗż. ņØ┤Ēøä ņŗ£Ē¢ēĒĢ£ ļćī MRIņØś FLAIR ņśüņāüņŚÉņä£ ņ¢æņĖĪ ļæÉņĀĢņŚĮ, ĒøäļæÉņŚĮ, ņĖĪļæÉņŚĮņŚÉ ņé░ņ×¼ĒĢ£ Ēö╝ņ¦łĒĢś ļ░▒ņ¦ł ļČĆņ£äņŚÉ Ļ│Ā ņŗĀĒśĖĻ░ĢļÅäņØś ļ│æļ│ĆņØ┤ ĒÖĢņØĖļÉśņŚłņ£╝ļ®░, ĒŖ╣Ē׳ ņØ┤ļ¤¼ĒĢ£ ņåīĻ▓¼ņØĆ ņÜ░ņĖĪņŚÉņä£ ņóĆ ļŹö ļÜ£ļĀĘĒĢśņśĆļŗż(Fig. 2A)
ņāüĻĖ░ ņåīĻ▓¼ļōżņØä ņóģĒĢ®ĒĢśņŚ¼ ĒĢŁņĢöņĀ£ņŚÉ ņØśĒĢ┤ ļ░£ĒśäĒĢ£ PRESļĪ£ ņ¦äļŗ©ĒĢśņśĆĻ│Ā, 3ņØ╝ ļÅÖņĢł ĒĢśļŻ© 1 gņØś methylprednisolone ņČ®Ļ▓® ņ╣śļŻī ļ░Å ĒĢŁĻ▓ĮļĀ©ņĀ£ Ēł¼ņĢĮ(valproate 1,600 mg/day, levetiracetam 3,000 mg/day)ņØä ņŗ£ņ×æĒĢśņśĆļŗż. ņ╣śļŻī Ēøä ņŗ£Ē¢ēĒĢ£ ļćīĒīīĻ▓Ćņé¼(Fig. 1B)ņÖĆ ļćī MRI (Fig. 2B)ņŚÉņä£ ņ¦äļŗ© ļŗ╣ņŗ£ ļ│┤ņśĆļŹś ņØ┤ņāü ņåīĻ▓¼ņØĆ ņé¼ļØ╝ņĪīņ£╝ļ®░, ņŗĀĻ▓ĮĒĢÖņĀü ņ”ØņāüņØ┤ ņŚåļŖö ņāüĒā£ļĪ£ Ēć┤ņøÉĒĢśņśĆļŗż.
ļŹ░ņŗ£ĒāĆļ╣łņØĆ ĻĖēņä▒Ļ│©ņłśņä▒ļ░▒Ēśłļ│æĻ│╝ MDS ĒÖśņ×ÉņŚÉĻ▓ī ĒĢŁņĢöĒÖöĒĢÖņÜöļ▓Ģ ņĢĮļ¼╝ļĪ£ ņé¼ņÜ®ļÉśļŖö DNA ļ®öĒŗĖņĀäņØ┤ĒÜ©ņåīņĀĆĒĢ┤ņĀ£ ņżæ ĒĢśļéśļĪ£, ņØ╝ļ░ś ņäĖĒżļ│┤ļŗż ļ¦ÄņØĆ ņ¢æņØś ļ®öĒŗĖĒÖöļÉ£ DNAļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŖö ņĢö ņäĖĒżņŚÉņä£ Ēāłļ®öĒŗĖĒÖöļź╝ ņ┤ēņ¦äņŗ£ņ╝£ ņĢö ņäĖĒżņØś ļīĆņé¼ļź╝ ņĀĆĒĢ┤ĒĢśļŖö ĻĖ░ņĀäņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. ļŗżļźĖ ĒĢŁņĢöņĀ£ņŚÉ ļ╣äĒĢśņŚ¼ ļ╣äĻĄÉņĀü ņĢłņĀäĒĢ£ ņĢĮļ¼╝5ļĪ£ 2006ļģäļÅä FDA ņŖ╣ņØĖņØä ļ░øņØä ļŗ╣ņŗ£ņŚÉļŖö Ļ│╝ļ®öĒŗĖĒÖöņŚÉ ņØśĒĢ┤ ļÅÖļ®┤ņāüĒā£ņØĖ ņóģņ¢æ ņ¢ĄņĀ£ ņ£ĀņĀäņ×Éļź╝ Ēāłļ®öĒŗĖĒÖö ĻĖ░ņĀäņØä ĒåĄĒĢ┤ ļŗżņŗ£ ĒÖ£ņä▒ņāüĒā£ļĪ£ ļ¦īļōżņ¢┤ ņóģņ¢æ ņäĖĒżņØś ļČäĒÖö, ņäĖĒżĻ│Āņé¼, ļģĖĒÖöļź╝ ņ┤ēņ¦äĒĢśļŖö Ļ│╝ņĀĢņØ┤ ņŻ╝ļ¬®ņØä ļ░øņĢśļŗż.6 ĒĢśņ¦Ćļ¦ī, ļŹ░ņŗ£ĒāĆļ╣łņØś ņĀĢĒÖĢĒĢ£ ĒĢŁņĢöĒÜ©Ļ│╝ ĻĖ░ņĀäņŚÉ ļīĆĒĢ┤ņä£ļŖö ņĢäņ¦ü ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ē ņżæņŚÉ ņ׳ņ£╝ļ®░, ņĄ£ĻĘ╝ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļŹ░ņŗ£ĒāĆļ╣łņØ┤ ļČĆļČäņĀüņ£╝ļĪ£ ļ®┤ņŚŁļ░śņØæņØä ĒÖ£ņä▒ĒÖöņŗ£ĒéżļŖö ĻĖ░ņĀäņØä ĒåĄĒĢ┤ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļéĖļŗżļŖö ņŻ╝ņןņØä ņĀ£ĻĖ░ĒĢśņśĆļŗż.7
ņØ┤ļ¤¼ĒĢ£ ļ®┤ņŚŁļ░śņØæĻ│╝ Ļ┤ĆļĀ©ĒĢśņŚ¼ ļŹ░ņŗ£ĒāĆļ╣łņØś ļō£ļ¼╝ņ¦Ćļ¦ī ņŗ¼Ļ░üĒĢ£ ļČĆņ×æņÜ® ņé¼ļĪĆĻ░Ć ņĄ£ĻĘ╝ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż. ĒĢ£ ņ”ØļĪĆ ļ│┤Ļ│ĀņŚÉņä£ļŖö ņĢĮļ¼╝ļĪ£ ņØĖĒĢ£ ĒśłņåīĒīÉĻ░Éņåīņ”Ø ņ╣śļŻīļź╝ ņ£äĒĢ┤ ļŹ░ņŗ£ĒāĆļ╣łņØä 3ņØ╝Ļ░ä ņé¼ņÜ®ĒĢ£ ĒÖśņ×ÉņŚÉĻ▓īņä£ ņŗĀ ĻĖ░ļŖź ņĢģĒÖöĻ░Ć ļ░£ņāØĒĢ£ ļÆż ņĪ░ņ¦üĻ▓Ćņé¼ļĪ£ ļ»ĖņäĖĒśłĻ┤Ćļ│æņ”Ø(thrombotic microangiopathy)ņØ┤ ņ¦äļŗ©ļÉśņŚłļŗż.8 ņĀĆņ×ÉļōżņØĆ ņĀĢĒÖĢĒĢ£ ļ░£ņāØ ĻĖ░ņĀäņØä ĒÖĢņØĖĒĢĀ ņłśļŖö ņŚåņŚłņ¦Ćļ¦ī, ļŹ░ņŗ£ĒāĆļ╣łņØä Ēł¼ņŚ¼ļ░øņØĆ ĒÖśņ×Éļōż ņØ╝ļČĆņŚÉņä£ 3ņŻ╝ ņĢłņŚÉ ņŗĀņןĻĖ░ļŖź ņØ┤ņāüņØ┤ ņ׳ņŚłļŗżļŖö ņäĀĒ¢ē ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ ņ”ØļĪĆ ļ│┤Ļ│ĀņØś ĒÖśņ×ÉņŚÉĻ▓īņä£ ļ»ĖņäĖĒśłĻ┤Ćļ│æņ”ØņØä ņØ╝ņ£╝Ēé¼ ļ¦īĒĢ£ ļŗżļźĖ ņäĀĒ¢ē ņøÉņØĖņØ┤ ņŚåņŚłļŗżļŖö Ļ▓āņØä ĻĘ╝Ļ▒░ļĪ£ ļŹ░ņŗ£ĒāĆļ╣łņØä ļ»ĖņäĖĒśłĻ┤Ćļ│æņ”ØņØś ņøÉņØĖņ£╝ļĪ£ ņČöņĀĢĒĢśņśĆļŗż.8 ņØ┤ļ▓ł ņ”ØļĪĆņŚÉņä£ļÅä ĒÖśņ×ÉļŖö ļŹ░ņŗ£ĒāĆļ╣ł Ēł¼ņŚ¼ Ēøä PRESņÖĆ Ļ┤ĆļĀ©ļÉ£ ņ”ØņāüņØ┤ 3ņŻ╝Ļ░Ć ņ¦Ćļé£ ņŗ£ņĀÉņŚÉņä£ ļ░£ņāØĒĢśņśĆļŖöļŹ░, ņØ┤ļŖö ļ®┤ņŚŁ ĻĖ░ņĀäņØ┤ ļćīĒśłĻ┤Ć ļé┤Ēö╝ņäĖĒż ņåÉņāüņØä ņØ╝ņ£╝ĒéżĻĖ░Ļ╣īņ¦Ć ņŗ£Ļ░äņØ┤ ņåīņÜöļÉśĻĖ░ ļĢīļ¼ĖņØĖ Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż.
PRESņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņĢģņä▒ Ļ│ĀĒśłņĢĢ ĒÖśņ×ÉņŚÉņä£ ļÅÖļ░śļÉśļŖö ļ»ĖņäĖĒśłĻ┤Ćļ│æņ”ØņØĆ Ļ│ĀĒśłņĢĢ ņØ┤ņÖĖņŚÉļÅä ņ×ÉĻ░Ćļ®┤ņŚŁ ĻĖ░ņĀä, ņĢģņä▒ņóģņ¢æ, ņĢĮņĀ£, ņ×äņŗĀ, ņØ┤ņŗØ ļō▒ 2ņ░©ņä▒ ņÜöņØĖņŚÉ ņØśĒĢ£ ļ»ĖņäĖĒśłĻ┤Ć ņåÉņāüņ£╝ļĪ£ ļ»ĖņäĖĒśłĻ┤ĆņÜ®Ēśłļ╣łĒśł, ĒśłņåīĒīÉĻ░Éņåīņ”ØņØ┤ ļÅÖļ░śļÉśļŖö ņ×äņāü ņ”ØĒøäĻĄ░ņØ┤ļŗż. PRESņÖĆ ļ╣äņŖĘĒĢ£ ļ░£ņāØ ņØĖņ×Éļź╝ Ļ│Ąņ£ĀĒĢśļŖö ļ¦īĒü╝ ļ»ĖņäĖĒśłĻ┤Ćļ│æņ”Ø ĒÖśņ×ÉļōżņØś ļćī MRIņŚÉņä£ PRESĻ░Ć ņ¦äļŗ©ļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż.9 ļśÉĒĢ£, ņØ┤ ļæÉ ņ”ØĒøäĻĄ░ņØś ņĪ░ņ¦üļ│æļ”¼ Ļ▓░Ļ│╝ņŚÉņä£ ĻĖēņä▒ ļ░Å ļ¦īņä▒ ĒśłĻ┤Ć ņåÉņāüņØ┤ ņ£Āņé¼ĒĢśĻ▓ī Ļ┤Ćņ░░ļÉ£ļŗżļŖö ņĀÉņØĆ ņØ┤ļōżņØś ļ░ĆņĀæĒĢ£ Ļ┤ĆļĀ©ņä▒ņØä ņŗ£ņé¼ĒĢśĻ│Ā ņ׳ļŗż.9
ņĢ×ņä£ņØś ņ”ØļĪĆ ļ│┤Ļ│Ā8ņŚÉņä£ ĒÖśņ×ÉņØś ņŗĀņןņŚÉ ļ»ĖņäĖĒśłĻ┤Ćļ│æņ”ØņØä ņ┤łļלĒĢ£ ļé┤Ēö╝ņäĖĒżņØś ĻĖ░ļŖź ņØ┤ņāü ĻĖ░ņĀäņØ┤ ņØ┤ļ▓ł ņ”ØļĪĆ ĒÖśņ×ÉņØś ļćīĒśłĻ┤Ć ļé┤Ēö╝ņäĖĒżņŚÉņä£ļÅä ļ░£ņāØĒ¢łņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ņ¦Ćļ¦ī, ņĀĢĒÖĢĒĢ£ ļ░£ņāØ ĻĖ░ņĀäņØä ņĢī ņłśļŖö ņŚåļŗż. ĒĢśņ¦Ćļ¦ī ņØ┤ļ▓ł ņ”ØļĪĆņØś ĒÖśņ×ÉņŚÉĻ▓ī PRESļź╝ ļ░£ņāØņŗ£Ēé¼ ļ¦īĒĢ£ ņäĀĒ¢ē ĒśłņĢĢ ņ”ØĻ░ĆĻ░Ć ņŚåņŚłļŗżļŖö ņĀÉĻ│╝ methylprednisolone ņé¼ņÜ® Ēøä ĒÖśņ×ÉņØś ņ”ØņāüņØ┤ ĒśĖņĀäļÉśņŚłļŗżļŖö ņĀÉņ£╝ļĪ£ ļ»ĖļŻ©ņ¢┤, ļŹ░ņŗ£ĒāĆļ╣łņØś ņĢö ņäĖĒżņŚÉ ļīĆĒĢ£ ļ®┤ņŚŁņøÉņä▒ ņ”Øņ¦äņØä ņ£ĀļÅäĒĢśļŖö ņØ╝ļČĆ ļ®┤ņŚŁņ▓┤Ļ│äņŚÉ ļīĆĒĢ£ ņ×æņÜ® ĻĖ░ņĀä7ņ£╝ļĪ£ ņØĖĒĢ┤ ļé┤Ēö╝ņäĖĒż ņåÉņāüņØ┤ ņ┤łļלļÉśņŚłņØä Ļ░ĆļŖźņä▒ņØä ņāØĻ░üĒĢ┤ ļ│╝ ņłś ņ׳ļŗż. ņŗżņĀ£ļĪ£ ļ¬ćļ¬ć ĒĢŁņĢöņĀ£ņŚÉņä£ ņÜ░ļ”¼ ļ¬ĖņØś ņĢö ņäĖĒżņŚÉ ļīĆĒĢ£ ņäĀņ▓£ ļ®┤ņŚŁņ▓┤Ļ│äņØś ĒÖ£ņä▒ņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö Ļ│╝ņĀĢņŚÉņä£ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ņāØņä▒Ļ│╝ ļé┤Ēö╝ņäĖĒżņØś ĒÖ£ņä▒ņ£╝ļĪ£ ņØĖĒĢ┤ ĒśłĻ┤Ćļćīņןļ▓Į ņåÉņāüņØ┤ ļéśĒāĆļéśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż.10
ņØ┤ņÖĆ Ļ░ÖņØ┤ ņØ┤ļ▓ł ņ”ØļĪĆņØś PRES ļ░£ļ│æņŚÉ ļ®┤ņŚŁ ĻĖ░ņĀäņØ┤ ņ×æņÜ®Ē¢łņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗżĻ│Ā ņāØĻ░üļÉśņ¢┤, ņĀĆņ×ÉļōżņØĆ ĻĘĖ ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ£ ņ×äņāüņŚ░ĻĄ¼Ļ░Ć ļČĆņĪ▒ĒĢśņŚ¼ PRESņØś Ēæ£ņżĆ ņ╣śļŻīļĪ£ ņĢīļĀżņ¦Ćņ¦Ć ņĢŖņØĆ methylprednisoloneņØä ņ¦äļŗ© ņ┤łĻĖ░ņŚÉ Ēł¼ņŚ¼ĒĢśņśĆļŗż. ņĄ£ĻĘ╝ņŚÉ ĒÖöĒĢÖņÜöļ▓ĢĻ│╝ Ļ┤ĆļĀ©ļÉśņ¢┤ ļ░£ņāØĒĢ£ PRES ĒÖśņ×É 70ļ¬ģņØś ņ”ØļĪĆ ļ│┤Ļ│ĀļōżņØä ļČäņäØĒĢ£ ļé┤ņÜ®ņŚÉ ļö░ļź┤ļ®┤, PRESļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŹś 70ļ¬ģ ņżæ 9ļ¬ģņŚÉņä£ Ļ│ĀņÜ®ļ¤ēņØś ņŖżĒģīļĪ£ņØ┤ļō£Ļ░Ć ņé¼ņÜ®ļÉśņŚłņ£╝ļéś ļīĆļČĆļČäņØś ņ╣śļŻī ņä▒ņĀüņØĆ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖņØĆ ĻĘĖļŻ╣Ļ│╝ ļ╣äņŖĘĒĢśņśĆļŗż. ĒĢśņ¦Ćļ¦ī, ņ╣śļŻī ĒĢśļŻ© ļ¦īņŚÉ ņŗĀĻ▓ĮĒĢÖņĀüņØĖ ņ”ØņāüņØ┤ ĻĖēĻ▓®ĒĢśĻ▓ī ĒśĖņĀäļÉśņŚłļŹś ņ”ØļĪĆļÅä ņ׳ņŚłļŗż.10 ļ¼╝ļĪĀ PRESņØś ņ╣śļŻī ņøÉņ╣ÖņØĆ Ļ│ĀĒśłņĢĢ ļ░Å ņŗĀļČĆņĀä ļō▒ ļ░£ļ│æ ņ£äĒŚś ņÜöņØĖļōżņØä ņŚäĻ▓®ĒĢśĻ▓ī Ļ┤Ćļ”¼ĒĢśļŖö Ļ▓āņØ┤ļ®░, ļ¬©ļōĀ ņ╣śļŻīĻ░Ć ļÅÖņŗ£ņŚÉ ņ¦äĒ¢ēļÉśĻĖ░ ļĢīļ¼ĖņŚÉ methylprednisoloneņØś ļŗ©ļÅģņĀüņØĖ ĒÜ©Ļ│╝ļź╝ ĒīÉļŗ©ĒĢśĻĖ░ ņ¢┤ļĀżņÜ░ļéś, ĒÖśņ×ÉņØś ņČöņĀĢ ļ░£ļ│æ ņøÉņØĖņŚÉ ļö░ļØ╝ ņŗĀņżæĒĢśĻ▓ī ņŖżĒģīļĪ£ņØ┤ļō£ ņ╣śļŻīļź╝ Ļ│ĀļĀżĒĢ┤ ļ│╝ ņłś ņ׳Ļ▓Āļŗż.
ļŹ░ņŗ£ĒāĆļ╣łņØĆ ļ╣äĻĄÉņĀü ņĢłņĀĢņĀüņ£╝ļĪ£ ĒÖśņ×ÉņØś ņāØņĪ┤ņ£©ņØä ļåÆņØ┤ļŖö ņĢĮļ¼╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. ņ×æņÜ® ĻĖ░ņĀäņŚÉ ļīĆĒĢ┤ņä£ļŖö ņĄ£ĻĘ╝Ļ╣īņ¦ĆļÅä ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ē ņżæņØ┤ņ¦Ćļ¦ī,7 Ēśäņ×¼ MDS ĒÖśņ×ÉņŚÉĻ▓ī ĒÖ£ļ░£Ē׳ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŖö ļ¦īĒü╝ ļČĆņ×æņÜ®ņŚÉ ļīĆĒĢ£ Ļ┤Ćņŗ¼ļÅä ņżæņÜöĒĢśļŗż. PRESņÖĆ Ļ┤ĆļĀ©ļÉ£ ņ£äĒŚśņØĖņ×Éļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ¦Ć ņĢŖņØĆ ĒÖśņ×ÉņŚÉņä£ ļŹ░ņŗ£ĒāĆļ╣ł Ēł¼ņŚ¼ Ēøä ņŗĀĻ▓ĮĻ│ä ņØ┤ņāüņØä ņŗ£ņé¼ĒĢśļŖö ņ”ØņāüņØ┤ ļéśĒāĆļé£ļŗżļ®┤, ņ”ēņŗ£ ņØ┤ņŚÉ ļīĆĒĢ£ ņČöĻ░ĆņĀüņØĖ ņ╣śļŻī ļ░Å ĒÅēĻ░Ćļź╝ ņĀüĻĘ╣ņĀüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢ┤ņĢ╝ ĒĢĀ Ļ▓āņØ┤ļŗż.
Fig.┬Ā1.
Electroencephalography (EEG) of the patient. (A) The initial EEG shows 2 to 3 Hz lateralized periodic discharges in the right temporoparietal region. (B) Follow-up EEG recorded 4 days later shows no epileptiform discharges.
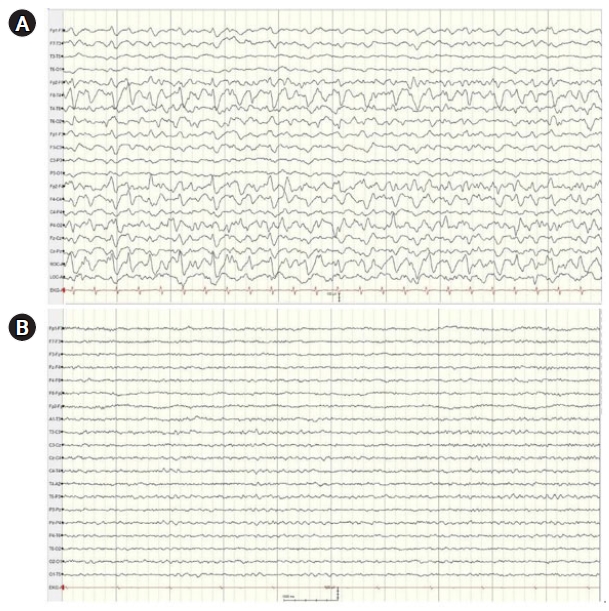
Fig.┬Ā2.
Magnetic resonance imaging fluid-attenuated inversion recovery (FLAIR) images at admission (A) and at discharge (B). (A) In FLAIR axial sections, extensive subcortical white matter edema is revealed in the bilateral parieto-occipital regions, with prominence on the right side. (B) FLAIR axial sections show near-complete resolution of high signal intensities compared with (A).
References
1. Hinchey J, Chaves C, Appignani B, et al. A reversible posterior leukoencephalopathy syndrome. N Engl J Med 1996;334:494ŌĆō500.


2. Gao B, Lyu C, Lerner A, McKinney AM. Controversy of posterior reversible encephalopathy syndrome: what have we learnt in the last 20 years? J Neurol Neurosurg Psychiatry 2018;89:14ŌĆō20.


3. Casey SO, Sampaio RC, Michel E, Truwit CL. Posterior reversible encephalopathy syndrome: utility of fluid-attenuated inversion recovery MR imaging in the detection of cortical and subcortical lesions. AJNR Am J Neuroradiol 2000;21:1199ŌĆō1206.


4. Granata G, Greco A, Iannella G, et al. Posterior reversible encephalopathy syndrome--Insight into pathogenesis, clinical variants and treatment approaches. Autoimmun Rev 2015;14:830ŌĆō836.


5. Kantarjian H, Issa JP, Rosenfeld CS, et al. Decitabine improves patient outcomes in myelodysplastic syndromes: results of a phase III randomized study. Cancer 2006;106:1794ŌĆō1803.


6. Santini V, Kantarjian HM, Issa JP. Changes in DNA methylation in neoplasia: pathophysiology and therapeutic implications. Ann Intern Med 2001;134:573ŌĆō586.


7. Kordella C, Lamprianidou E, Kotsianidis I. Mechanisms of action of hypomethylating agents: endogenous retroelements at the epicenter. Front Oncol 2021;11:650473.



8. Qin AB, Tan Y, Su T. Decitabine-induced kidney thrombotic microangiopathy with glomerular crescents formation and tubular necrosis: a case report. Medicine (Baltimore) 2020;99:e22901.









